19
2019.03
口腔微生物與口腔疾病的關係
原創文章 引用請註明出處
國人往往疏忽口腔健康問題,根據衛福部統計,台灣2~3歲兒童蛀牙率約 31%,到了6歲蛀牙率更增加到 79%,而成年人也有近8成有牙周病問題。每年3月20日是「世界口腔健康日」,讓我們一同以科學研究成果關心口腔微生物與口腔健康的關係吧!
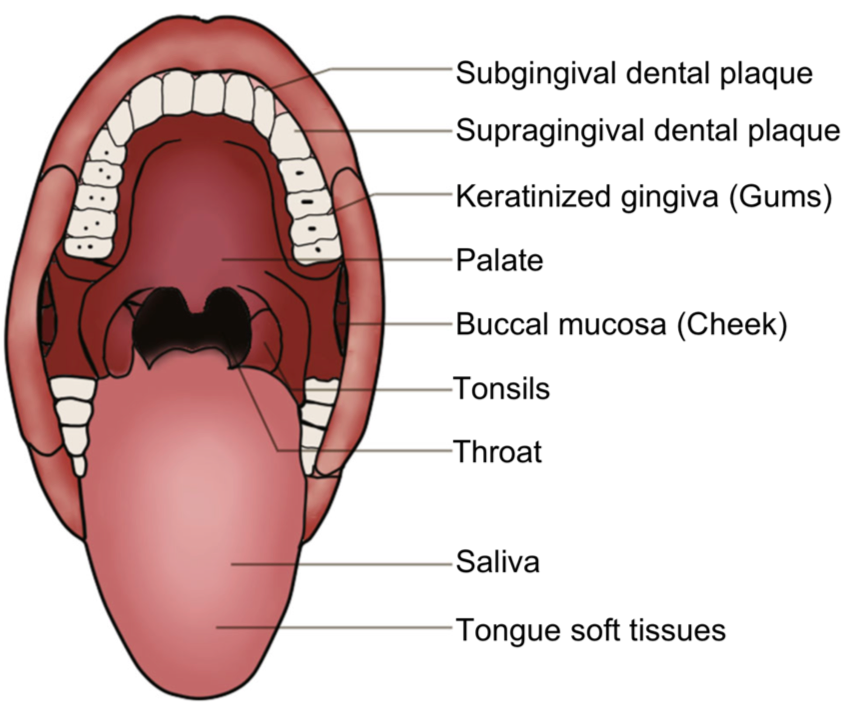
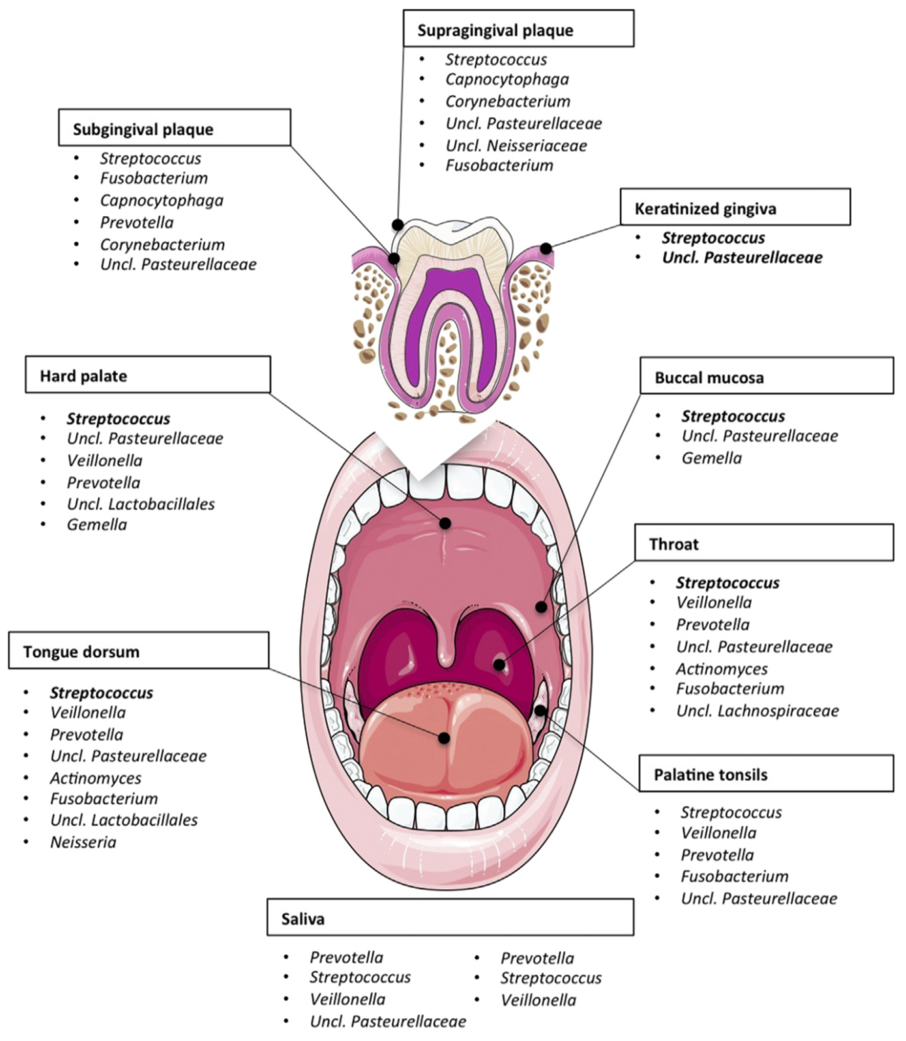
口腔微生物與齲齒、牙菌斑、牙結石、牙周病、口腔黏膜潰爛等有密不可分的關係。在國際大型研究計畫中(HMP),便從受測人群採集九個口腔部位(齦下牙菌斑、齦上牙菌斑、角質化牙齦、上顎、頰黏膜、扁桃體、咽喉、唾液、舌軟組織)的樣品做菌相分析,藉此了解不同部位主要的微生物結構。
在口腔中,大多部位以鏈球菌 (Streptococcus)為主,其中頰粘膜中為嗜血桿菌 (Haemophilus),齦上牙菌斑為放線菌 (Actinomyces),齦下牙菌斑為普雷沃氏菌 (Prevotella)。
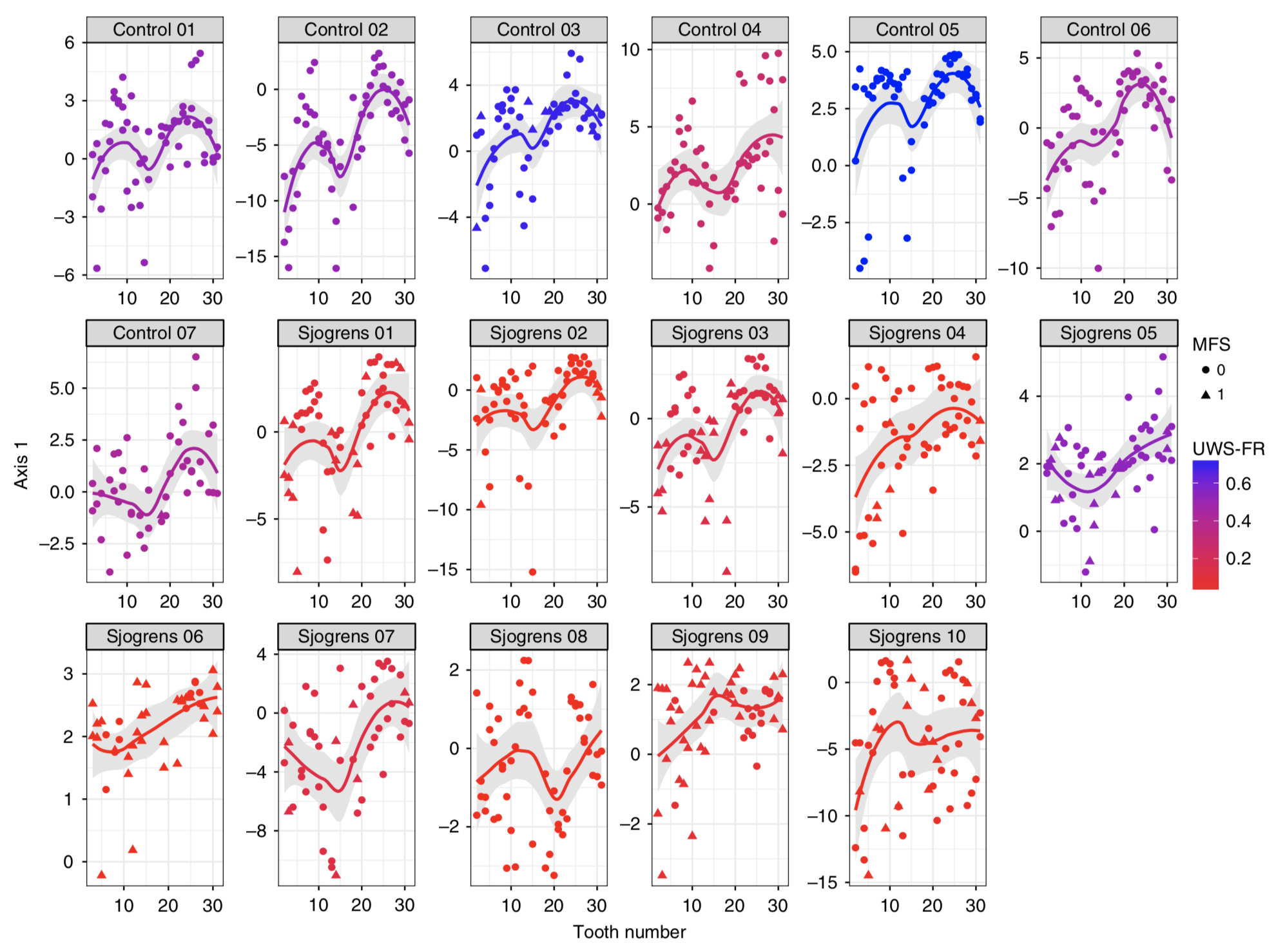
究竟口腔微生物建立有什麼特點呢?科學家透過分析沒有發生齲齒的健康兒童多個部位的口腔菌組成,鑑定出口腔菌定殖的兩個關鍵期:出牙前 & 乳牙萌出 [1]。針對唾液流動對口腔微生物的影響則有研究透過 9,000 多個牙齒和粘膜樣本進行分析,了解到唾液流動會影響口腔菌相的空間梯度變化 [2]。
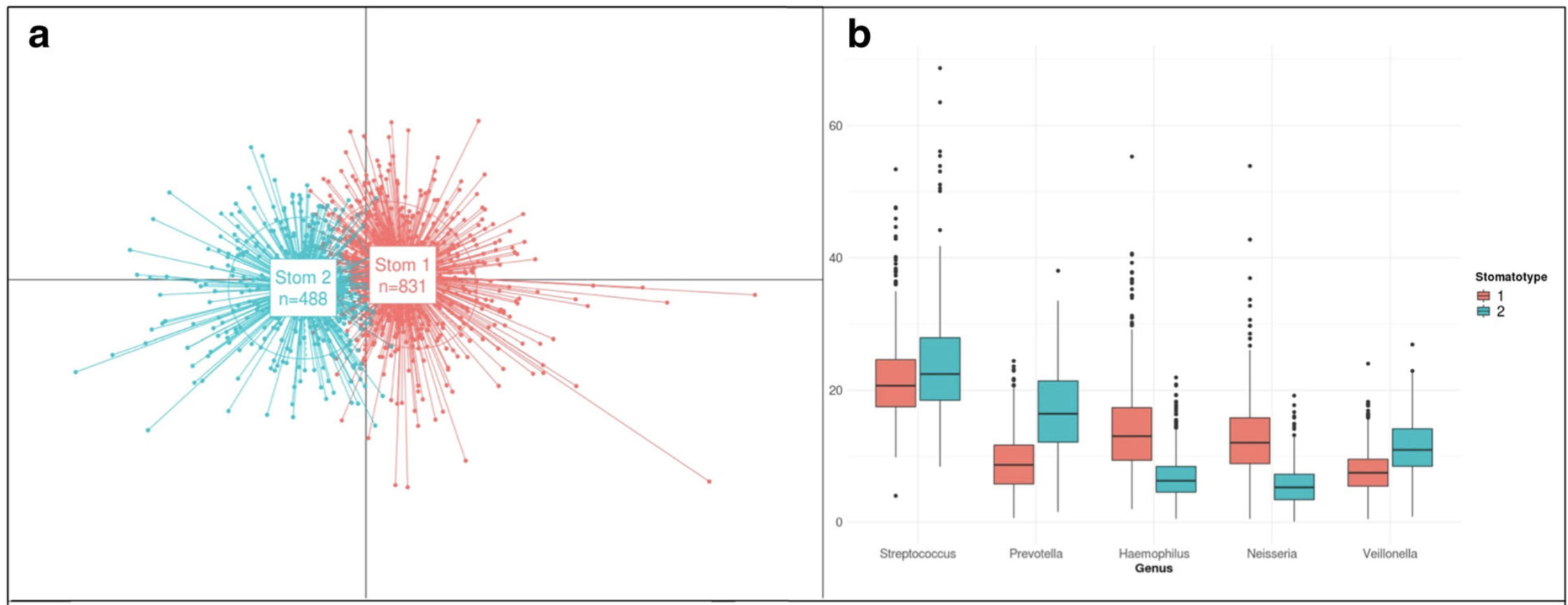
2018年西班牙研究 1,500 名青少年的唾液樣本,發現豐度最高的前十種菌屬佔所有定序序列的 84.64%,且在 99.6% 的樣本中出現,包括 Streptococcus,Prevotella,Haemophilus,Neisseria,Veillonella 等。並且將口腔微生物組成分為兩種主要的口腔型 (stomatotypes):(1) Neisseria (奈瑟菌) (2) Prevotella (普雷沃氏菌) [3]。關於唾液的多寡,亦有研究指出分泌減少對口腔菌相的組成結構相比於健康人有顯著性影響[4]。
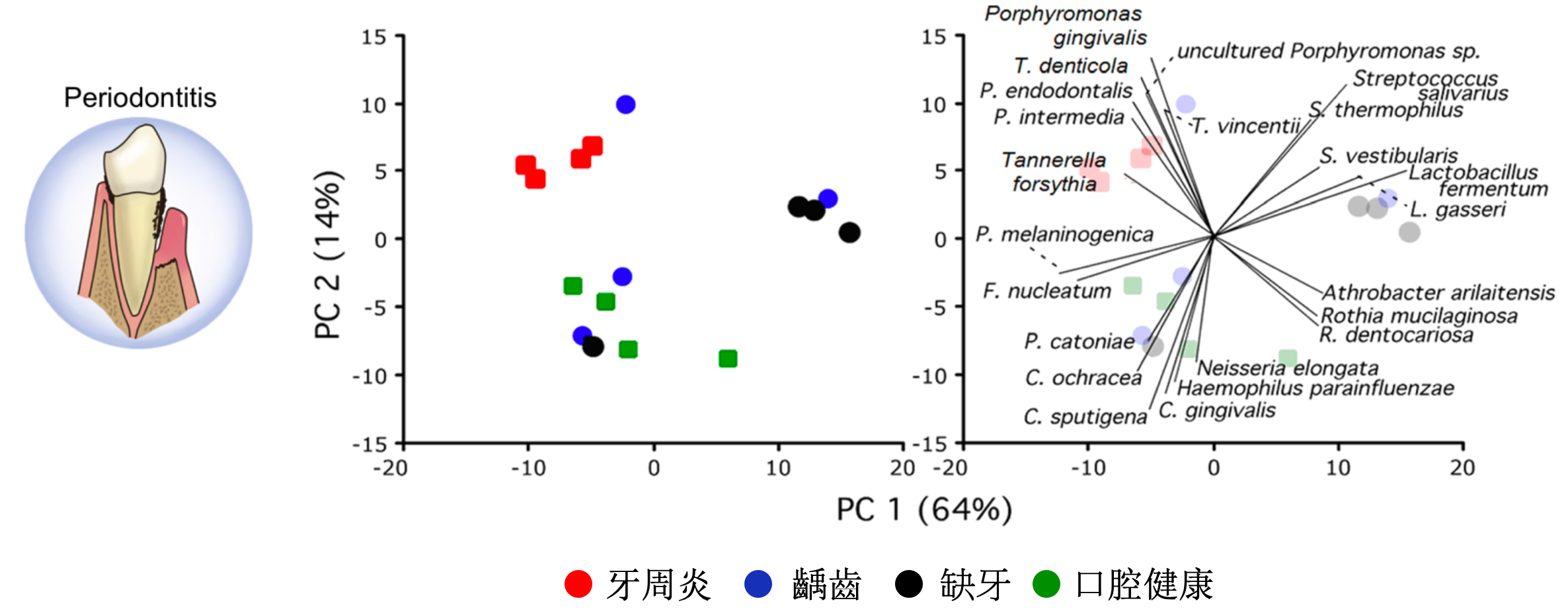
不同疾病健康狀態下的口腔菌相結構的研究方面,研究顯示不同牙周健康狀態影響了口腔菌的變化,而在牙醫治療後與疾病相關的細菌有下降的趨勢、與健康相關的細菌則有上升的趨勢[5]。其中口腔疾病尤以牙齒問題與微生物最為關聯,例如齲齒是以細菌為主要病原體,由口腔微生物與牙齒表面之間的生態平衡破壞所引起,比較嚴重早發性幼兒齲齒 (SECC)和健康兒童唾液與齦上牙菌斑的菌相。共檢測到 379 種細菌,發現包括鏈球菌,卟啉單胞菌和放線菌與SECC密切相關,可能是幼兒齲齒的潛在生物標誌物 [6]。另外,牙周病也是人的口腔常見疾病,可分為兩類:牙齦炎和牙周炎,科學家透過 16 名成年白人的口腔狀況分別有牙周炎、齲齒、缺牙、口腔健康,研究顯示牙周炎和其他狀況相比有 29 種細菌在數量上有顯著的統計差異 [7]。口腔黏膜疾病的口腔扁平苔蘚 (OLP)是一種常見的慢性粘膜發炎疾病,口腔內長期存在OLP有罹患癌症的風險,科學家利用 18 名健康口腔、19 名網狀型 OLP 患者、18 名潰瘍型 OLP 患者的唾液樣本做口腔微生物研究,發現Streptococcus parasanguinis, Rothia aeria, Haemophilus parainfluenzae 在潰瘍型 OLP 顯著減少,Prevotella melaninogenica 在網狀型 OLP 顯著增加 [8]。
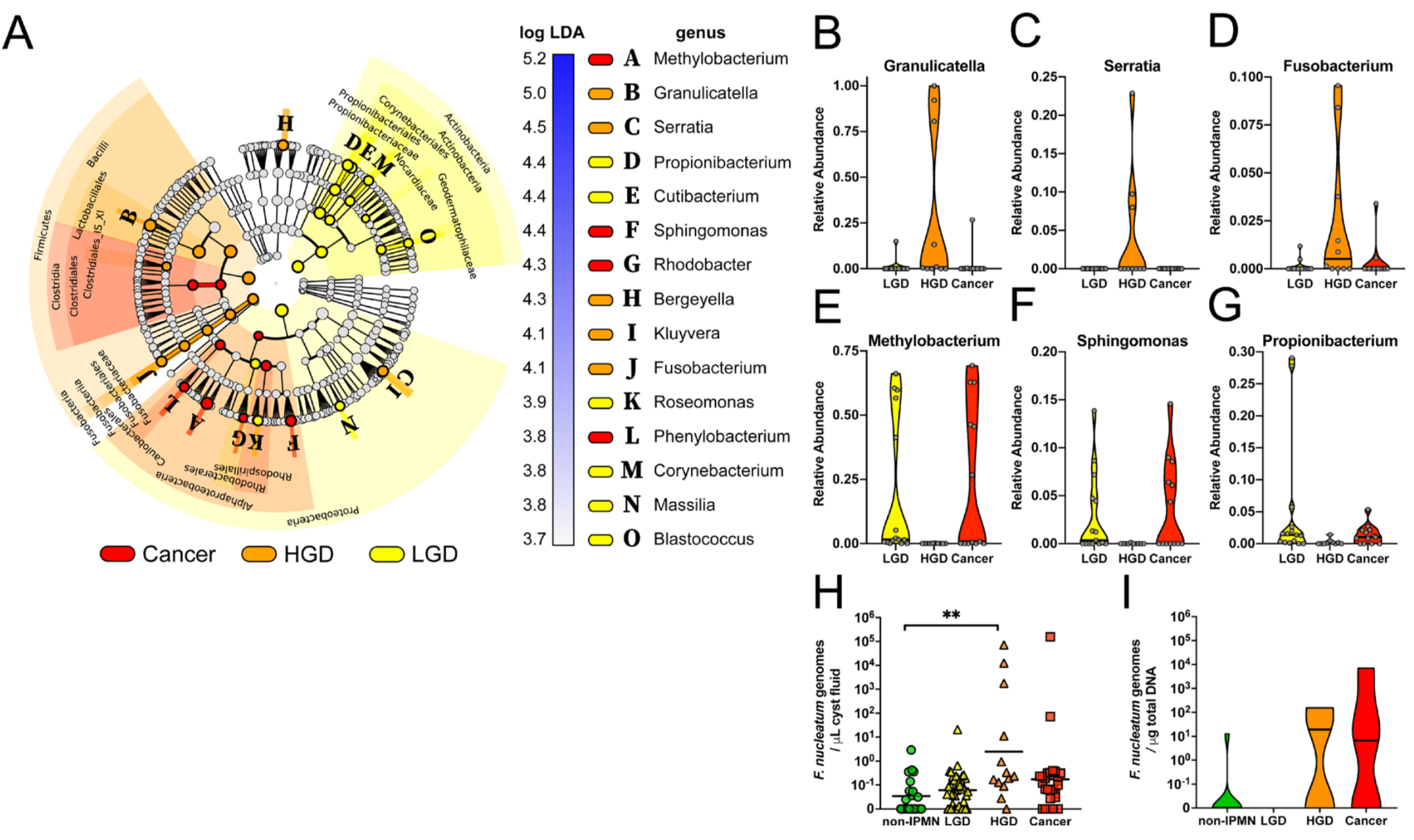
在癌症研究上,除了口腔癌與口腔菌相關外 [9, 10],目前有許多研究指出口腔細菌的改變可增加胰腺癌的發生風險,存在牙齦病病史且口腔健康狀況較差可能提高胰腺癌的發生風險。2018年發表在Gut上的最新研究,以 361 名胰腺癌患者未發病時的口腔細菌樣本,與 371 名非胰腺癌人群口腔細菌樣本進行比對,發現口腔微生物中存在兩種特定細菌,含有其中任一種細菌胰腺癌的發生風險相對較高(牙齦卟啉單胞菌、伴放線放線桿菌分別可增加 59% 與 50% 總體胰腺癌的發生風險),而這兩種類型的細菌都是已知牙齦疾病或牙周炎發生密切相關的微生物 [11]。另外,2019年的Gut一項對 105 個疑似胰腺囊性腫瘤患者的研究,發現口腔細菌與胰腺囊性腫瘤的惡性程度顯著相關 [12]。
由這麼多重要的研究可知,口腔微生物與口腔疾病關係密不可分,因此好好照護我們的口腔健康,是居家日常保健的重要工作。
參考文獻
[1] Mason, M. R., Chambers, S., Dabdoub, S. M., Thikkurissy, S., & Kumar, P. S. (2018). Characterizing oral microbial communities across dentition states and colonization niches. Microbiome, 6(1), 1–10.
參考文獻
[1] Mason, M. R., Chambers, S., Dabdoub, S. M., Thikkurissy, S., & Kumar, P. S. (2018). Characterizing oral microbial communities across dentition states and colonization niches. Microbiome, 6(1), 1–10.
[2] Proctor, D. M., Fukuyama, J. A., Loomer, P. M., Armitage, G. C., Lee, S. A., Davis, N. M., et al. (2018). A spatial gradient of bacterial diversity in the human oral cavity shaped by salivary flow. Nature Communications, 9(1), 1–10.
[3] Willis, J. R., González-Torres, P., Pittis, A. A., Bejarano, L. A., Cozzuto, L., Andreu-Somavilla, N., et al. (2018). Citizen science charts two major “stomatotypes” in the oral microbiome of adolescents and reveals links with habits and drinking water composition, 1–17.
[4] van der Meulen, T. A., Harmsen, H. J. M., Bootsma, H., Liefers, S. C., Vich Vila, A., Zhernakova, A., et al. (2018). Reduced salivary secretion contributes more to changes in the oral microbiome of patients with primary Sjögren’s syndrome than underlying disease. Annals of the Rheumatic Diseases, annrheumdis–2018–213026–4.
[5] Chen, C., Hemme, C., Beleno, J., Shi, Z. J., Ning, D., Qin, Y., et al. (2018). Oral microbiota of periodontal health and disease and their changes after nonsurgical periodontal therapy. The ISME Journal, 10, 1–15.
[6] Ma, C., Chen, F., Zhang, Y., Sun, X., Tong, P., Si, Y., & Zheng, S. (2015). Comparison of Oral Microbial Profiles between Children with Severe Early Childhood Caries and Caries-Free Children Using the Human Oral Microbe Identification Microarray. PLoS ONE, 10(3), e0122075–12.
[7] Pozhitkov, A. E., Leroux, B. G., Randolph, T. W., Beikler, T., Flemmig, T. F., & Noble, P. A. (2015). Towards microbiome transplant as a therapy for periodontitis: an exploratory study of periodontitis microbial signature contrasted by oral health, caries and edentulism. BMC Oral Health, 1–11.
[8] Wang, K., Lu, W., Tu, Q., Ge, Y., He, J., Zhou, Y., et al. (2016). Preliminary analysis of salivary microbiome and their potential roles in oral lichen planus. Scientific Reports, 1–10. [9] Furquim, C. P., Soares, G. M. S., Ribeiro, L. L., Azcarate-Peril, M. A., Butz, N., Roach, J., et al. (2016). The Salivary Microbiome and Oral Cancer Risk. Journal of Dental Research, 0022034516678169–8.
[10] Lee, W.-H., Chen, H.-M., Yang, S.-F., Liang, C., Peng, C.-Y., Lin, F.-M., et al. (2017). Bacterial alterations in salivary microbiota and their association in oral cancer. Scientific Reports, 7(1), 1–11.
[11] Fan, X., Alekseyenko, A. V., Wu, J., Peters, B. A., Jacobs, E. J., Gapstur, S. M., et al. (2018). Human oral microbiome and prospective risk for pancreatic cancer: a population-based nested case-control study. Gut, 67(1), 120–127.
[12] Gaiser, R. A., Halimi, A., Alkharaan, H., Lu, L., Davanian, H., Healy, K., et al. (2019). Enrichment of oral microbiota in early cystic precursors to invasive pancreatic cancer. Gut, gutjnl–2018–317458–9.
圖爾思生物科技 / 微生物體研究中心
郭育倫 文案