RNP(核糖核蛋白):CRISPR Plasmid的最佳替代方案
編輯效率
在所有測試濃度下,使用插入/缺失(indel)頻率來評估編輯效率的結果顯示RNP複合物比質體具有更高且更一致的編輯效率(見圖1)。這歸因於sgRNA的高純度和化學修飾,以及作為RNPs進行轉染的特點。一旦進入細胞核,RNPs能夠立即開始編輯,而質體則需要進行進一步的轉錄和轉譯步驟才能進行基因編輯。
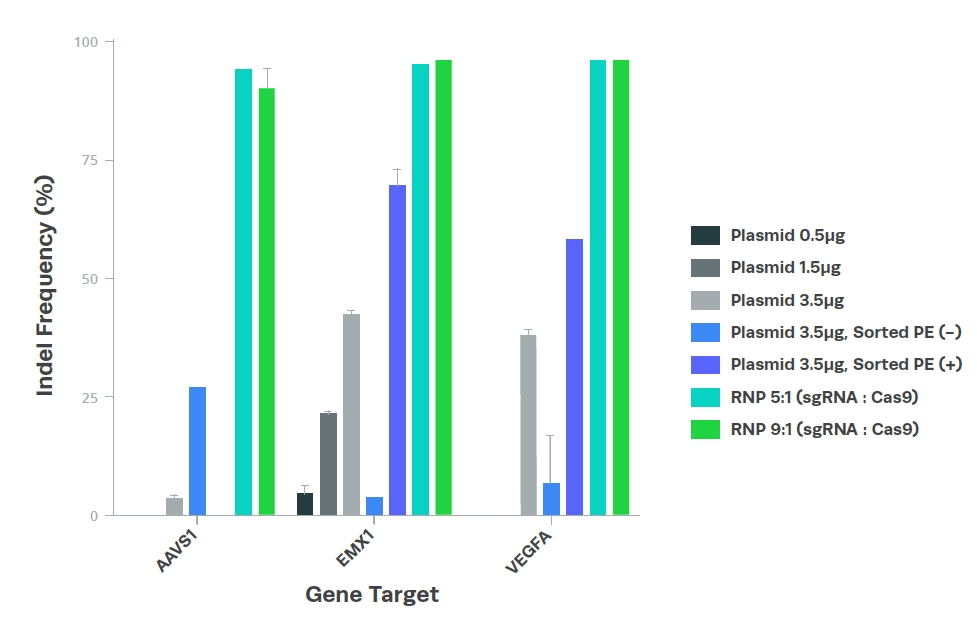
Figure 1. Synthetic sgRNA outperforms plasmids.
Editing efficiencies for plasmid versus synthetic sgRNA (transfected as RNPs) for three target genes (AAVS1, EMX1, and VEGFA).
細胞存活率
相較於質體,sgRNA表現出較高的細胞存活率(見圖2)。這種差異部分是由於sgRNA的化學修飾使其具有較低的免疫原性,從而防止了先天性的免疫反應。此外,在初代細胞和多能幹細胞中,外源DNA的存在可能會觸發環鳥苷酸-腺苷酸合成酶的活化(cyclic GMP-AMP synthase activation)。對於這些特殊的細胞類型,使用RNP的形式進行轉染極有可能具有更低的細胞毒性。
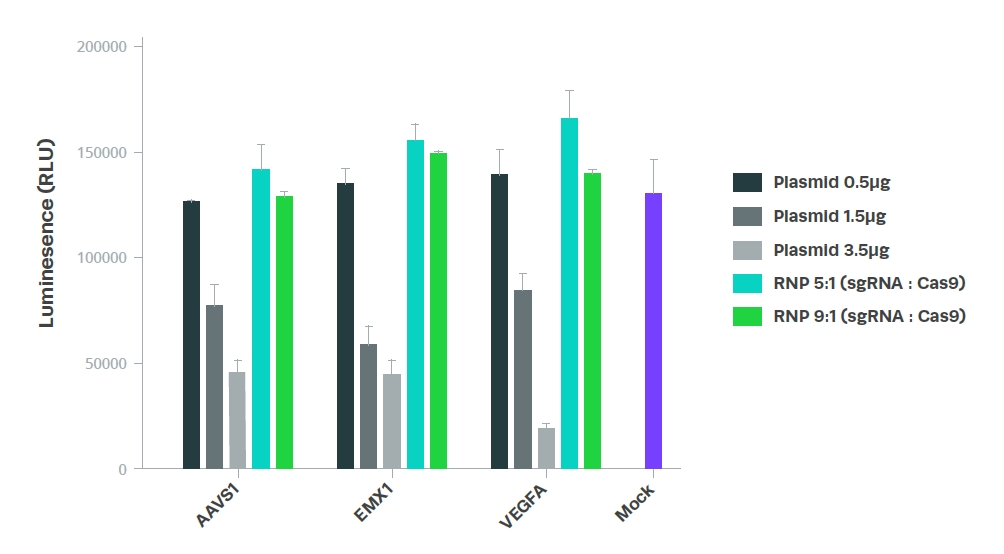
Figure 2. Comparison of cell viability between plasmid and RNP delivery of sgRNA and Cas9.
Cell viability was assessed using the CellTiter-Glo® Luminescent Cell Viability Assay.
脫靶效應與其他考慮因素
質體需要較長的時間才能開始編輯並且非常穩定,在開始降解之前質體會在細胞中保留數週並在此期間持續進行轉錄,從而增加了脫靶編輯的風險。另一方面,以RNP複合物的方式進行轉染則不需要轉錄或轉譯,RNP的快速動力學意味著基因編輯在轉染後便可以很快的開始進行,持續時間也僅有幾個小時到幾天不等。RNP複合物約在一天後便開始降解,降低了脫靶效應的機會。
質體轉染的另一個潛在問題是質體DNA有隨機整合到目標細胞基因組中的風險。隨機整合可能會干擾必需基因。而使用RNP進行轉染則完全避免了DNA整合的風險,提供了更安全的選擇。
資料來源: Synthego



