26
2023.09
圖爾思RNAi小學堂
圖爾思RNAi小學堂
RNAi是一種天然的基因沉默(silencing)現象,最早在線蟲中被發現,是由短片段RNA(siRNA)調控mRNA導致基因靜默的作用,它存在於所有的真核生物之中,包括原生生物、真菌、藻類、植物與動物,調控內原基因表現與抵抗外源核酸入侵的自我保衛機制,被認為是最初作為抗病毒的免疫機制之一。
主要是藉由非小編碼RNA(Small non-coding RNA,sncRNA)來調控mRNA,造成降解、抑制轉錄等,使得mRNA無法轉譯成蛋白質的轉錄後基因靜默作用(post transcriptional gene silencing, PTGS)。
主要是藉由非小編碼RNA(Small non-coding RNA,sncRNA)來調控mRNA,造成降解、抑制轉錄等,使得mRNA無法轉譯成蛋白質的轉錄後基因靜默作用(post transcriptional gene silencing, PTGS)。
RNAi可以分為外源性與內源性2種,外源性有siRNA/shRNA與內源性的miRNA:
1. siRNA作用機制
外源性dsRNA誘導的siRNA作用機制如下步驟:
1. siRNA作用機制
外源性dsRNA誘導的siRNA作用機制如下步驟:
(i)細胞吸收外源dsRNAs後,核酸內切酶(Dicer)迅速將其剪切成長約20-30個核甘酸的,5’有一個磷酸基團,3’有一個羫基突出2個核苷酸的siRNAs,正反股是完全互補配對。
(ii)siRNAs的被納入AGO2蛋白質中,形成一個siRNA誘導沉默複合物(siRNA-induced silencing complex,siRISC),siRISC中的siRNA經AGO2作用分解成兩條單股,正股被釋放出去,反股則留在siRISC中。
(iii)最後,含有反股的siRISC分子,在反股的siRNA指引下,透過鹼基互補的方式與目標基因結合,進而誘導目標基因silencing,從而實現轉錄後基因沉默(PTGS)。PTGS發生後,siRISC會與目標基因被釋放,尋找其他目標基因並結合,持續誘導新的目標基因沉默。
(ii)siRNAs的被納入AGO2蛋白質中,形成一個siRNA誘導沉默複合物(siRNA-induced silencing complex,siRISC),siRISC中的siRNA經AGO2作用分解成兩條單股,正股被釋放出去,反股則留在siRISC中。
(iii)最後,含有反股的siRISC分子,在反股的siRNA指引下,透過鹼基互補的方式與目標基因結合,進而誘導目標基因silencing,從而實現轉錄後基因沉默(PTGS)。PTGS發生後,siRISC會與目標基因被釋放,尋找其他目標基因並結合,持續誘導新的目標基因沉默。
2. shRNA作用機制
外源性shRNA轉染進細胞後誘導產生siRNA的作用機制如下步驟:
(i)利用病毒感染或者細胞轉染方式將shRNAy載體送入目標細胞,細胞核內經由RNA聚合酶 (Pol Ⅱ/Pol Ⅲ)轉錄得到pri-shRNA,pri-miRNA具有5’Cap、3’ poly(A)tail與一個或數個loop的RNA,長達約為數百個鹼基大小。
(ii)pri-miRNA會被RNA核酸酶(Drosha Ribonuclease III, Drosha)去除5’Cap與3’ poly(A)Tail含有loop,長約50-70個鹼基的pre-shRNA
(iii)pre-shRNA會從核內被運送到細胞質,被Dicer切成程度約20-30個核甘酸的,5’有一個磷酸基團,3’有一個羫基突出2個核苷酸的siRNAs,正反股是完全互補配對。
(iv)siRNAs的被納入AGO2蛋白質中,形成一個siRNA誘導沉默複合物(siRNA-induced silencing complex,siRISC),siRISC中的siRNA經AGO2作用分解成兩條單股,正股被釋放出去,反股則留在siRISC中。
(v)最後,含有反股的siRISC分子,在反股的siRNA指引下,透過鹼基互補的方式與目標基因結合,進而誘導目標基因silencing,從而實現轉錄後基因沉默(PTGS)。PTGS發生後,siRISC會與目標基因被釋放,尋找其他目標基因並結合,持續誘導新的目標基因沉默。
(ii)pri-miRNA會被RNA核酸酶(Drosha Ribonuclease III, Drosha)去除5’Cap與3’ poly(A)Tail含有loop,長約50-70個鹼基的pre-shRNA
(iii)pre-shRNA會從核內被運送到細胞質,被Dicer切成程度約20-30個核甘酸的,5’有一個磷酸基團,3’有一個羫基突出2個核苷酸的siRNAs,正反股是完全互補配對。
(iv)siRNAs的被納入AGO2蛋白質中,形成一個siRNA誘導沉默複合物(siRNA-induced silencing complex,siRISC),siRISC中的siRNA經AGO2作用分解成兩條單股,正股被釋放出去,反股則留在siRISC中。
(v)最後,含有反股的siRISC分子,在反股的siRNA指引下,透過鹼基互補的方式與目標基因結合,進而誘導目標基因silencing,從而實現轉錄後基因沉默(PTGS)。PTGS發生後,siRISC會與目標基因被釋放,尋找其他目標基因並結合,持續誘導新的目標基因沉默。
3. miRNA作用機制
內源性miRNA誘導的基因沉默機制如下步驟:
(i)細胞核內miRNA基因在RNA聚合酶(Pol Ⅱ/Pol Ⅲ)轉錄得到pri-miRNA,pri-miRNA具有5’Cap、3’ poly(A)tail與一個或數個loop的RNA,長達數千到數萬個鹼基不等的長度。
(ii)pri-miRNA會被RNA核酸酶(Drosha Ribonuclease III, Drosha)去除5’Cap與3’ poly(A)Tail含有loop,長約70個鹼基的pre-miRNA,且是5′具有磷酸基團,3′具有羥基並突出2 個鹼基,正反股是部分互補配對。
(iii)pre-miRNA會從核內被運送到細胞質,被Dicer切成程度約19-25個鹼基的雙股miRNA duplex
(iv)miRNA duplex會與AGO1結合,形成一個miRNA誘導沉默複合物(miRNA-induced silencing complex,miRISC),miRNA duplex正股會馬上被降解,反股miRNA則會保留在miRISC中。miRISC在反股miRNA的指引下藉由鹼基互補方式來辨別目標基因,進而降解或沉默目標基因。
(ii)pri-miRNA會被RNA核酸酶(Drosha Ribonuclease III, Drosha)去除5’Cap與3’ poly(A)Tail含有loop,長約70個鹼基的pre-miRNA,且是5′具有磷酸基團,3′具有羥基並突出2 個鹼基,正反股是部分互補配對。
(iii)pre-miRNA會從核內被運送到細胞質,被Dicer切成程度約19-25個鹼基的雙股miRNA duplex
(iv)miRNA duplex會與AGO1結合,形成一個miRNA誘導沉默複合物(miRNA-induced silencing complex,miRISC),miRNA duplex正股會馬上被降解,反股miRNA則會保留在miRISC中。miRISC在反股miRNA的指引下藉由鹼基互補方式來辨別目標基因,進而降解或沉默目標基因。
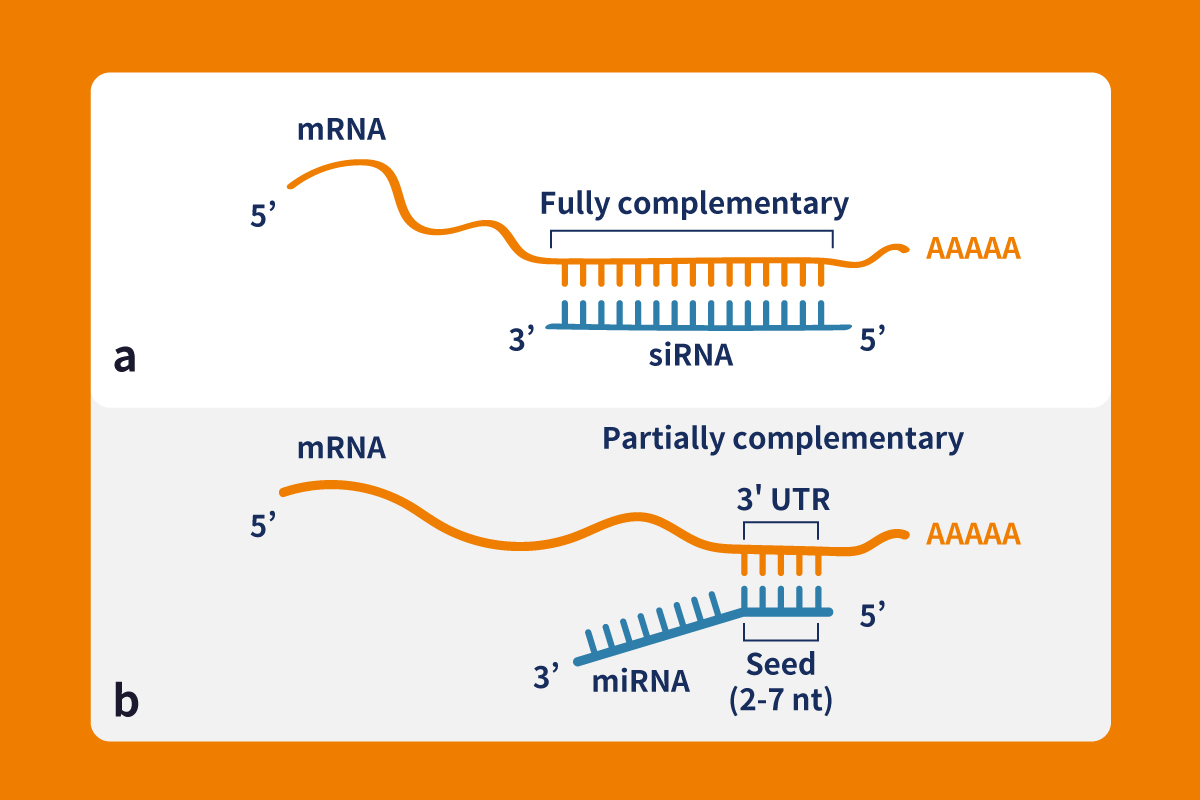
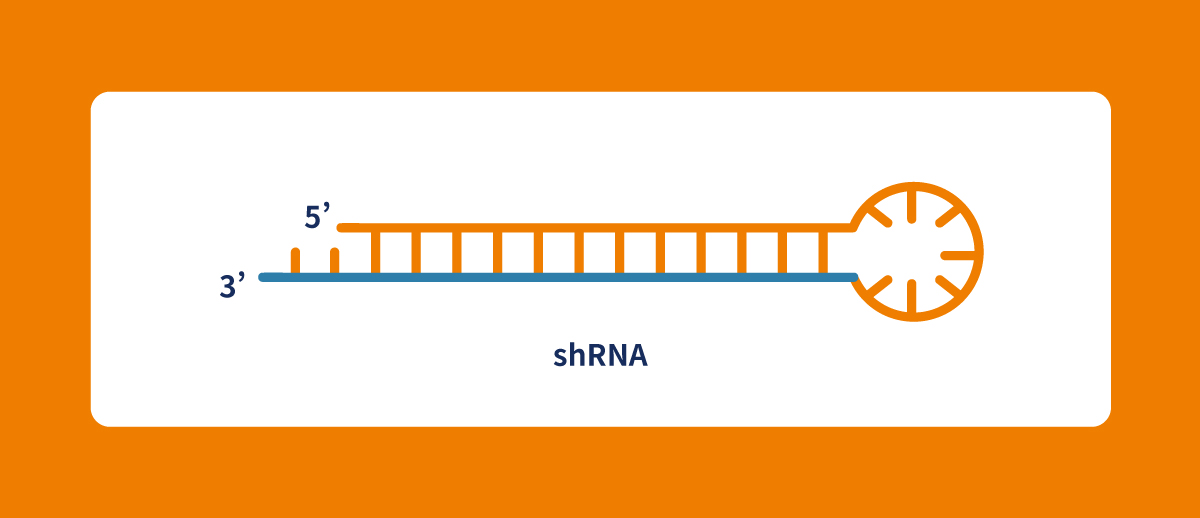
siRNA、shRNA和miRNA的差異特點
A. 三者的最終功能性型態都是長度在19-30核甘酸的small RNA,siRNA是3’有兩個游離的羫基,5’有磷酸基團的dsRNA,shRNA經過加工形成siRNA,miRNA則最終形成單股RNA。
B. siRNA一般是人工合成的linear dsRNA,shRNA、miRNA則是通過hair loop結構形成的雙股RNA。siRNA和shRNA的雙股是完全互補配對,而miRNA則是以部分互補的形式作用。
C. shRNA和miRNA的有類似的生成路徑,但shRNA在功能上與siRNA更接近。shRNA在細胞內被Dicer酶切割後形成siRNA,通過siRNA途徑行使干擾功能,而miRNA則是通過另一條不同的途徑調控目標基因。
D. shRNA以載體形式存在,能長時間在細胞內進行基因調控,shRNA可持續轉錄生產siRNA,半衰期可達數周至一個月以上,siRNA與miRNA送入細胞後馬上就會作用,半衰期相對較短,只有24-48小時,無法長時間作用,只能短暫影響細胞表現。
E. siRNA與miRNA在細胞內的濃度是會隨著mRNA數量和轉染效率影響,隨著時間的增加逐漸減少,而shRNA可通過對啟動子的誘導調控來控制表達量,並能夠持續表達。
B. siRNA一般是人工合成的linear dsRNA,shRNA、miRNA則是通過hair loop結構形成的雙股RNA。siRNA和shRNA的雙股是完全互補配對,而miRNA則是以部分互補的形式作用。
C. shRNA和miRNA的有類似的生成路徑,但shRNA在功能上與siRNA更接近。shRNA在細胞內被Dicer酶切割後形成siRNA,通過siRNA途徑行使干擾功能,而miRNA則是通過另一條不同的途徑調控目標基因。
D. shRNA以載體形式存在,能長時間在細胞內進行基因調控,shRNA可持續轉錄生產siRNA,半衰期可達數周至一個月以上,siRNA與miRNA送入細胞後馬上就會作用,半衰期相對較短,只有24-48小時,無法長時間作用,只能短暫影響細胞表現。
E. siRNA與miRNA在細胞內的濃度是會隨著mRNA數量和轉染效率影響,隨著時間的增加逐漸減少,而shRNA可通過對啟動子的誘導調控來控制表達量,並能夠持續表達。
如何選擇siRNA、shRNA或者miRNA?
1. siRNA: 實驗者所使用細胞便於轉染或電穿孔,著重在實驗週期,快速觀察到目標基因抑制表現,或者想通過螢光或其他分子標記檢測mRNA等。
2. shRNA: 實驗人員想徹底沉默目標基因,或者想通過誘導在特定時期產生干擾效應,或者想建立穩定表現的細胞株,或者植物基因等。
3. miRNA: 內源非編碼的miRNA調控研究,miRNA對某表現所有調控路徑的影響,目標基因不能夠被完全沉默,否則會導致細胞死亡,如housekeeping基因等。
2. shRNA: 實驗人員想徹底沉默目標基因,或者想通過誘導在特定時期產生干擾效應,或者想建立穩定表現的細胞株,或者植物基因等。
3. miRNA: 內源非編碼的miRNA調控研究,miRNA對某表現所有調控路徑的影響,目標基因不能夠被完全沉默,否則會導致細胞死亡,如housekeeping基因等。
圖爾思RNAi合成服務特色
◆ 特殊化學修飾,提升細胞內的穩定性與轉染效率,更不容易被降解、作用時間更持久。
◆ 規格多元,提供各式實驗套組選擇,滿足in vitro與in vivo的實驗需求。
◆ 多種shRNA vector及Lentivirus shRNA vector可供免費選擇。
◆ 獨家RNAi合成套組方案,未達抑制效果未達70%以上,無條件換貨。
◆ 規格多元,提供各式實驗套組選擇,滿足in vitro與in vivo的實驗需求。
◆ 多種shRNA vector及Lentivirus shRNA vector可供免費選擇。
◆ 獨家RNAi合成套組方案,未達抑制效果未達70%以上,無條件換貨。
1. Lam JK, Chow MY, Zhang Y, Leung SW. siRNA Versus miRNA as Therapeutics for Gene Silencing. Mol Ther Nucleic Acids. 2015 Sep 15;4(9):e252. doi: 10.1038/mtna.2015.23. PMID: 26372022; PMCID: PMC4877448.
2. Setten, R. L., Rossi, J. J., & Han, S. (2019). The current state and future directions of RNAi-based therapeutics. Nature Reviews Drug Discovery, 18(6), 421–446. doi:10.1038/s41573-019-0017-4
3. Svoboda P (2020) Key Mechanistic Principles and Considerations Concerning RNA Interference.
Front. Plant Sci. 11:1237. doi: 10.3389/fpls.2020.01237
2. Setten, R. L., Rossi, J. J., & Han, S. (2019). The current state and future directions of RNAi-based therapeutics. Nature Reviews Drug Discovery, 18(6), 421–446. doi:10.1038/s41573-019-0017-4
3. Svoboda P (2020) Key Mechanistic Principles and Considerations Concerning RNA Interference.
Front. Plant Sci. 11:1237. doi: 10.3389/fpls.2020.01237



