07
2017.10
10x Genomics 讓 “腸識” 變成 “常識”
原創文章 引用請註明出處
“腸道益生菌”, “腸道菌相的平衡” 可以說是近來最熱門的討論話題。目前,社會大眾漸漸了解腸道內細菌的種類、數量跟身體的免疫系統以及很多疾病的發生息息相關,但是除了這些之外,腸道本身的健康也是另一個不容忽視的環節。腸道內細胞每天都有大量的磨損,為了維持腸道本身的健全,腸道幹細胞(Lgr5+ intestinal stem cells, ISCs)自我再生(self-renew)及分化(differentiation)之間的調節就成了腸道如何返老還童的關鍵。
在過去的研究裡指出,Wnt/catenin及R-spondin (RSPO)這兩種訊息傳導調控著腸道幹細胞的再生與分化,然而受限於細胞中不只有一種的Wnt、RSPO配體(ligand)跟受體(receptor),因此對於這兩種訊息傳導之間的關係一直缺乏相關的研究。近來,史丹佛大學的研究團隊發表於nature期刊上的成果顯示,他們以小鼠為研究物種,利用In Vivo cell tracing的技術並結合10x Genomics Single Cell RNA Sequencing的技術平台成功的釐清這兩種訊息傳導之間的相互關係,進而在腸道幹細胞的調控機制上得到了重大的突破。
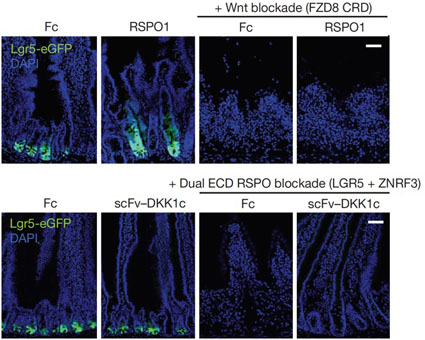
在他們的研究裡指出, 當他們在老鼠體內表現RSPO ligand時(RSPO1處理組)會誘導腸道幹細胞的大量增生(帶綠色螢光的細胞),但是此現象會因為Wnt訊息傳導路徑被FZD8 CRD所抑止而消失; 相反的,藉由scFv-DKK1c的表現在老鼠體內誘導Wnt訊息傳導的活化並無法增加腸道幹細胞的數量,但是如果將RSPO訊息傳導截斷的話(LGR5+ZNRF3 處理組)則會造成腸道幹細胞的數量大幅下降。
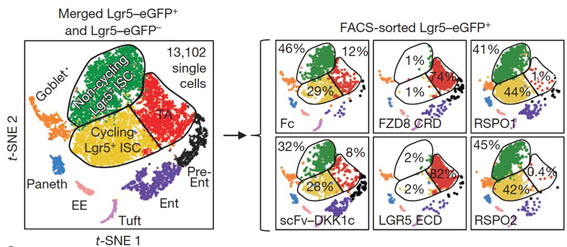
此外,當他們把腸道幹細胞利用10x Genomics的平台進行Single Cell RNA Sequencing的分析後發現,除了各種的前驅細胞亞型外,腸道幹細胞還可以被區分為三大細胞亞群,分別是循環型腸道幹細胞(Cycling Lgr5+ ISCs)、非循環型腸道幹細胞(Non-cycling Lgr5+ ISCs)以及暫時增生細胞(transit amplifying, TA)。從結果顯示,利用scFv-DKK1c來誘導Wnt訊息傳遞活化對於腸道幹細胞的組成並沒有產生任何的改變,但是如果利用FZD8 CRD或是LGR5 ECD分別阻斷Wnt或RSPO的訊息傳導時會使得幹細胞(Lgr5+)轉變成TA細胞,進而進行細胞的分化; 相反的,RSPO訊息傳導高度活化(RSOP1和RSPO2處理組)則會將TA細胞群轉變成幹細胞群。
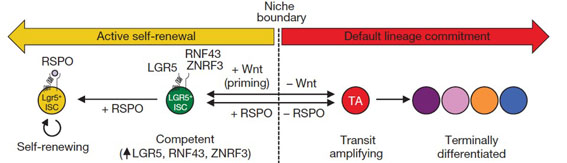
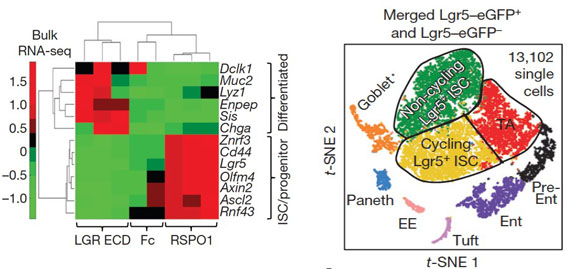
進一步的,藉由比較各個不同細胞群的基因表現圖譜後發現,活化Wnt訊息傳導會誘導幹細胞大量的表現LGR5、RNF43及ZNRF3等RSPO的受體(receptor)。因此,綜合所得的結果他們提出了一個假說:一般狀況下ISCs細胞是傾向於轉變成TA細胞,並進行細胞分化。而Wnt及RSPO這兩個訊息傳導的同時作用會將幹細胞導向自我再生(self-renew)的路徑上。其中,Wnt訊息傳導會誘導幹細胞表面大量的表現RSPO的受體(receptor),而RSPO訊息則是在ISCs細胞自我再生的調控上扮演著最關鍵的角色.
結論
伴隨著單細胞定序技術的日漸純熟,使得在幹細胞的研究上得到了重大的突破。以這篇研究為例,傳統的RNA-seq只能比較不同處理組的ISCs細胞之間,其基因表現量的差異。然而藉由單細胞的RNA 定序卻可以了解在相同的處理條件下, 不同ISCs細胞亞群之間的動態變化,進而從中發現調控ISCs細胞self-renew及differentiation的機制。因此,10x Genomics Single Cell RNA Sequencing可以說是在幹細胞的研究領域上不可或缺的利器。
參考文獻
Yan KS, Janda CY, Chang J, Zheng GXY, Larkin KA, Luca VC, Chia LA, Mah AT, Han A, Terry JM, Ootani A, Roelf K, Lee M, Yuan J, Li X, Bolen CR, Wilhelmy J, Davies PS, Ueno H, von Furstenberg RJ, Belgrader P, Ziraldo SB, Ordonez H, Henning SJ, Wong MH, Snyder MP, Weissman IL, Hsueh AJ, Mikkelsen TS, Garcia KC, Kuo CJ. (2017). Non-equivalence of Wnt and R-spondin ligands during Lgr5+ intestinal stem-cell self-renewal. Nature:238-242.
“腸道益生菌”, “腸道菌相的平衡” 可以說是近來最熱門的討論話題。目前,社會大眾漸漸了解腸道內細菌的種類、數量跟身體的免疫系統以及很多疾病的發生息息相關,但是除了這些之外,腸道本身的健康也是另一個不容忽視的環節。腸道內細胞每天都有大量的磨損,為了維持腸道本身的健全,腸道幹細胞(Lgr5+ intestinal stem cells, ISCs)自我再生(self-renew)及分化(differentiation)之間的調節就成了腸道如何返老還童的關鍵。
在過去的研究裡指出,Wnt/catenin及R-spondin (RSPO)這兩種訊息傳導調控著腸道幹細胞的再生與分化,然而受限於細胞中不只有一種的Wnt、RSPO配體(ligand)跟受體(receptor),因此對於這兩種訊息傳導之間的關係一直缺乏相關的研究。近來,史丹佛大學的研究團隊發表於nature期刊上的成果顯示,他們以小鼠為研究物種,利用In Vivo cell tracing的技術並結合10x Genomics Single Cell RNA Sequencing的技術平台成功的釐清這兩種訊息傳導之間的相互關係,進而在腸道幹細胞的調控機制上得到了重大的突破。
在他們的研究裡指出, 當他們在老鼠體內表現RSPO ligand時(RSPO1處理組)會誘導腸道幹細胞的大量增生(帶綠色螢光的細胞),但是此現象會因為Wnt訊息傳導路徑被FZD8 CRD所抑止而消失; 相反的,藉由scFv-DKK1c的表現在老鼠體內誘導Wnt訊息傳導的活化並無法增加腸道幹細胞的數量,但是如果將RSPO訊息傳導截斷的話(LGR5+ZNRF3 處理組)則會造成腸道幹細胞的數量大幅下降。

此外,當他們把腸道幹細胞利用10x Genomics的平台進行Single Cell RNA Sequencing的分析後發現,除了各種的前驅細胞亞型外,腸道幹細胞還可以被區分為三大細胞亞群,分別是循環型腸道幹細胞(Cycling Lgr5+ ISCs)、非循環型腸道幹細胞(Non-cycling Lgr5+ ISCs)以及暫時增生細胞(transit amplifying, TA)。從結果顯示,利用scFv-DKK1c來誘導Wnt訊息傳遞活化對於腸道幹細胞的組成並沒有產生任何的改變,但是如果利用FZD8 CRD或是LGR5 ECD分別阻斷Wnt或RSPO的訊息傳導時會使得幹細胞(Lgr5+)轉變成TA細胞,進而進行細胞的分化; 相反的,RSPO訊息傳導高度活化(RSOP1和RSPO2處理組)則會將TA細胞群轉變成幹細胞群。

進一步的,藉由比較各個不同細胞群的基因表現圖譜後發現,活化Wnt訊息傳導會誘導幹細胞大量的表現LGR5、RNF43及ZNRF3等RSPO的受體(receptor)。因此,綜合所得的結果他們提出了一個假說:一般狀況下ISCs細胞是傾向於轉變成TA細胞,並進行細胞分化。而Wnt及RSPO這兩個訊息傳導的同時作用會將幹細胞導向自我再生(self-renew)的路徑上。其中,Wnt訊息傳導會誘導幹細胞表面大量的表現RSPO的受體(receptor),而RSPO訊息則是在ISCs細胞自我再生的調控上扮演著最關鍵的角色.

結論
伴隨著單細胞定序技術的日漸純熟,使得在幹細胞的研究上得到了重大的突破。以這篇研究為例,傳統的RNA-seq只能比較不同處理組的ISCs細胞之間,其基因表現量的差異。然而藉由單細胞的RNA 定序卻可以了解在相同的處理條件下, 不同ISCs細胞亞群之間的動態變化,進而從中發現調控ISCs細胞self-renew及differentiation的機制。因此,10x Genomics Single Cell RNA Sequencing可以說是在幹細胞的研究領域上不可或缺的利器。

參考文獻
Yan KS, Janda CY, Chang J, Zheng GXY, Larkin KA, Luca VC, Chia LA, Mah AT, Han A, Terry JM, Ootani A, Roelf K, Lee M, Yuan J, Li X, Bolen CR, Wilhelmy J, Davies PS, Ueno H, von Furstenberg RJ, Belgrader P, Ziraldo SB, Ordonez H, Henning SJ, Wong MH, Snyder MP, Weissman IL, Hsueh AJ, Mikkelsen TS, Garcia KC, Kuo CJ. (2017). Non-equivalence of Wnt and R-spondin ligands during Lgr5+ intestinal stem-cell self-renewal. Nature:238-242.
圖爾思生物科技/NGS事業部 莊景凱 文案 © BIOTOOLS. All Rights Reserved



