10
2016.08
微生物抗藥基因資料庫
抗生素的大量使用,導致耐藥性菌株大規模增加,土壤、水體、人體、動植物等環境,都有大量新的抗藥菌株和耐藥基因被發現。對這些耐藥菌株和基因進行監測,分析耐藥基因動態,對於解析耐藥基因產生機制、防治抗藥菌株氾濫有著重要的意義。這其中最核心的內容就是耐藥基因資料庫,一個完備、精確、更新及時的資料庫,是耐藥基因篩查工作的核心。我們這就來介紹目前常用的耐藥基因資料庫,看一看我們手中擁有哪些核心武器~
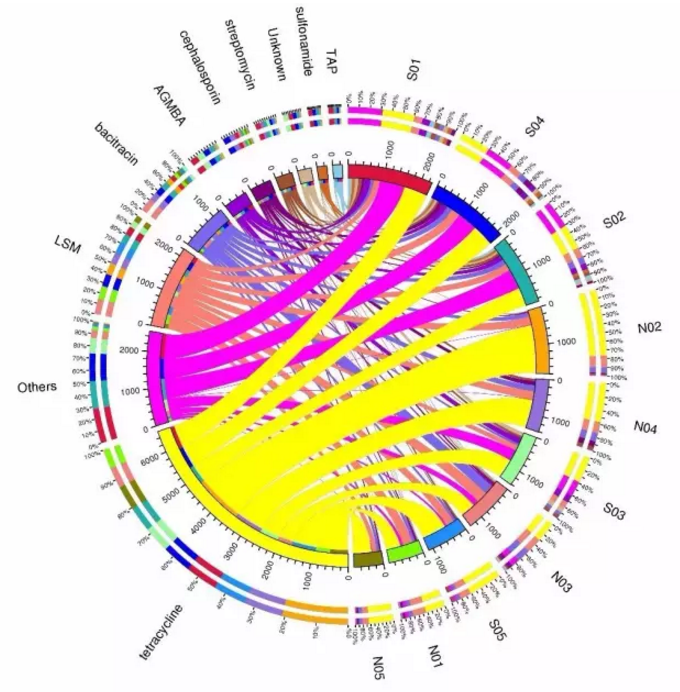
圖1. 抗性基因分析示意圖
耐藥基因資料庫的先驅— ARDB
自從抗生素使用以來,對這些成分產生耐藥性的基因也逐漸被發現,為收集整理強耐藥性的菌株,科學家們整理了一系列相關的資料庫,其中最先真正將各種微生物中的抗藥基因全面整合起來的資料庫,就是ARDB(Antibiotic Resistance Genes Database)資料庫[1]。
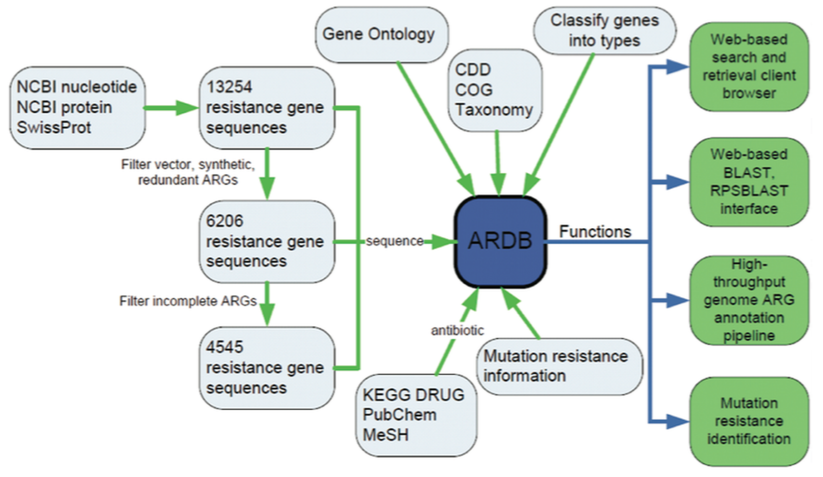
ARDB資料庫整合了來自NCBI和SwissProt資料庫中13,254個耐藥基因資訊,經過資料過濾和去除重複後,保留4,554個完整非冗餘的耐藥蛋白資料。這些蛋白資料和GO、CDD、COG、物種資訊等資料整合,並根據耐藥機制進行歸類,構成了ARDB資料庫的核心架構[2]。
圖2. ARDB資料庫組成及建構方法[2]
來自志願者的貢獻— CARD
抗性基因資料庫的建構,是一個複雜的系統工程,以ARDB為例,自從09年上線以來少有更新,與此不無關係。然而抗性基因並不是一成不變的,隨著菌株的不斷進化,以及新抗生素的生產和使用,新的耐藥基因也陸續產生。如何讓資料庫能夠與時俱進,適應不斷更新的耐藥基因資訊,成為抗性基因資料庫建構的一大難題。
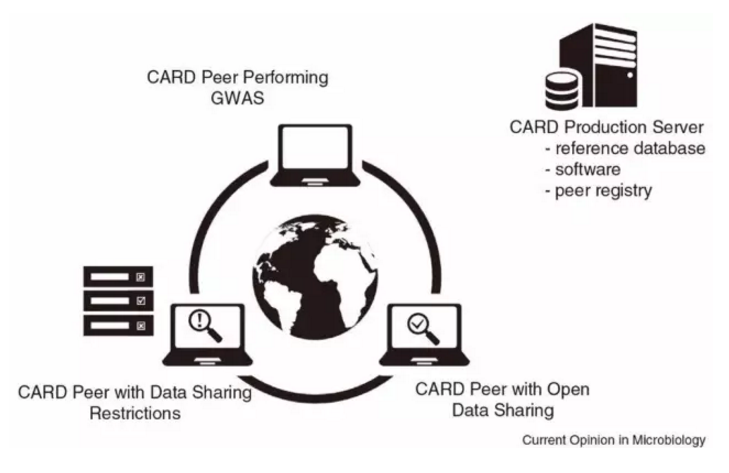
CARD資料庫[3]在建構之初就充分考慮到了這點,建立基於志願者貢獻的資訊共享平台[4],以ARO(Antibiotic Resistance Ontology)為核心對抗性資料進行組織[5],以達到資料即時更新的效果。
圖3. CARD資料共享網絡示意圖[5]
專注重要結構域— ResFams
蛋白質結構中,真正起到核心功能的,是其中最核心的幾個結構域。相比通過全序列相似度來進行資料庫註釋,基於隱馬可夫(HMM)模型的結構域預測,能夠更準確的對蛋白功能做出註釋。特別是對於宏基因體資料,即便序列結構不完整的基因,只要保留了關鍵結構域,也能夠預測蛋白的核心功能。
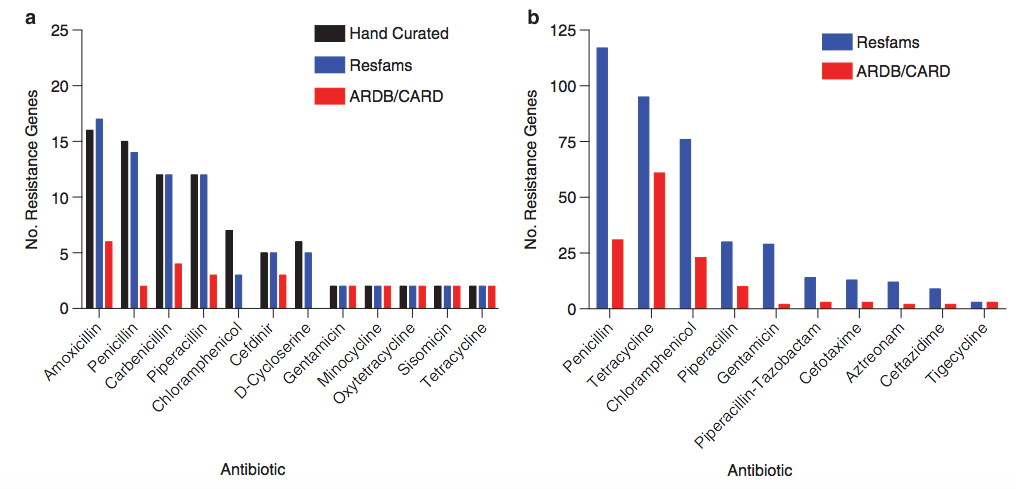
Res Fams [6]以CARD的抗藥基因資料為核心,結合已有多個抗藥基因資料庫建構了HMM模型,以提升抗藥基因預測效果。基於土壤(圖4a)和人腸道環境(圖4b)宏基因體的抗藥基因預測結果顯示,ResFams資料庫預測得到的抗藥基因數目優於ARDB/CARD的預測結果,與人工最佳化過的標準預測結果相比,假陽性率極低,顯示了很好的預測效果[7]。
圖4. 基於土壤(圖4a)和人類腸道環境(圖4b)宏基因體的抗藥基因預測結果[7]
基於宏基因體的抗性基因註釋
抗生素的使用對人體環境和自然環境都產生著重要的影響,使用宏基因體對水體[8]、糞便/土壤[9]、活性淤泥[10]以及人類腸道[11]等環境的抗性基因研究,均有文獻報導。
參考文獻
[1] ARDB資料庫:http://ardb.cbcb.umd.edu/
[2] Liu B, Pop M. ARDB--Antibiotic Resistance Genes Database.[J]. NucleicAcids Research , 2009, 37(Database issue):443-7.
[3] CARD資料庫:https://card.mcmaster.ca/
[4] Mcarthur AG, Wright G D. Bioinformatics of antimicrobial resistance in the age of molecular epidemiology[J]. Current Opinion in Microbiology , 2015, 27:45-50.
[5] Mcarthur AG, Waglechner N, Nizam F, et al . The Comprehensive Antibiotic Resistance Database[J]. Antimicrobial Agents & Chemotherapy ,2013, 57(7):3348-57.
[6] ResFams資料庫:http://www.dantaslab.org/resfams
[7] Gibson MK, Forsberg KJ, Dantas G. Improved annotation of antibiotic resistance determinants reveals microbial resistomes cluster by ecology[J]. Isme Journal , 2014, 9(1).
[8] Christgen B, Yang Y, Ahammad SZ, et al . Metagenomics Shows That Low-Energy Anaerobic−Aerobic Treatment Reactors Reduce Antibiotic Resistance Gene Levels from Domestic Wastewater[J]. Environmental Science &Technology , 2015, 49(4):2577 -84.
[9] Pehrsson EC, Tsukayama P, Patel S, et al . Interconnected microbiomes and resistomes in low-income human habitats[J]. Nature , 2016, 533(7602):212-216.
[10] Tian Z, Zhang Y, Yu B, et al . Changes of resistome, mobilome and potential hosts of antibiotic resistance genes during the transformation of anaerobic digestion from mesophilic to thermophilic.[J]. Water Research , 2016,98:261 -269.
[11] Hu Y, Yang X, Qin J, et al . Metagenome-wide analysis of antibiotic resistance genes in a largecohort of human gut microbiota.[J]. Nature Communications , 2013, 4(2):405-415.
圖爾思生物科技 / 諾禾致源文案
(插圖來源於網路,侵刪)