30
2019.04
單細胞研究的樣品萃取指南
單細胞研究的樣本萃取指南
單細胞定序(scRNA-seq)是目前最火熱的研究工具之一,單細胞定序(scRNA-seq)能大規模的進行基因體的相關研究,而研究所產出的數據能帶給醫療與生命科學相當大的啟發,目前單細胞研究也已經為胚胎發育學、老化學與癌症研究領域提供了大量有意義的數據。雖然單細胞定序(scRNA-seq)是一個非常棒的研究工具,但是其實驗的難度卻是相當高,舉凡樣品種類的選擇、足夠細胞數量的取得、單細胞定序技術的選擇、生物資訊分析工作的策略都是影響單細胞定序(scRNA-seq)產出數據品質的因素,因此每個環節都是非常重要的。

"Nature Protocol s" 近期即針對單細胞定序(scRNA-seq)的操作步驟提出了實驗操作指南,這次就為大家導覽文章中的針對 "單細胞樣品製備" 操作上的注意事項:
- 樣品的準備:準備高品質的單細胞樣品絕對是單細胞定序(scRNA-seq)能得到高品質數據的要素之一,目前大部分都是使用新鮮的活細胞、保存過的珍貴樣品或是冷凍組織來進行單細胞定序(scRNA-seq)的實驗,因此 "Nature Protocols" 針對這些樣品種類提供了通用型的操作指南以及針對特定組織樣品的參數設定指南。首先,強烈建議採用無菌的方式來取得這些樣品,所有用來取得樣品的試劑與耗材都應該使用 nuclease-free 等級以避免污染。而為了降低取得樣品的過程中對細胞的損傷,在抽吸樣品和離心時都必須要使用最輕度的力度和轉速。若細胞堆疊的狀況比較嚴重時則會需要使用額外的處理方法,但這時候必須要小心這些方法有可能會損害細胞。除此之外,進行細胞清洗的過程中建議要加入足夠體積的洗液以避免細胞堆疊太過於嚴重,而洗液的成分則推薦含有牛血清白蛋白的磷酸鹽溶液(不能含有鈣或是鎂離子)為佳。若樣品為primary cell、幹細胞或是一些較為敏感的細胞,清洗的過程則需要使用特殊的洗液以維持細胞的活性,處理過程要盡量在30分鐘內完成。最後,在單細胞準備的過程中,最要注意的就是避免細胞聚集、死亡的細胞、無細胞的核酸和反轉錄脢抑制劑的存在。
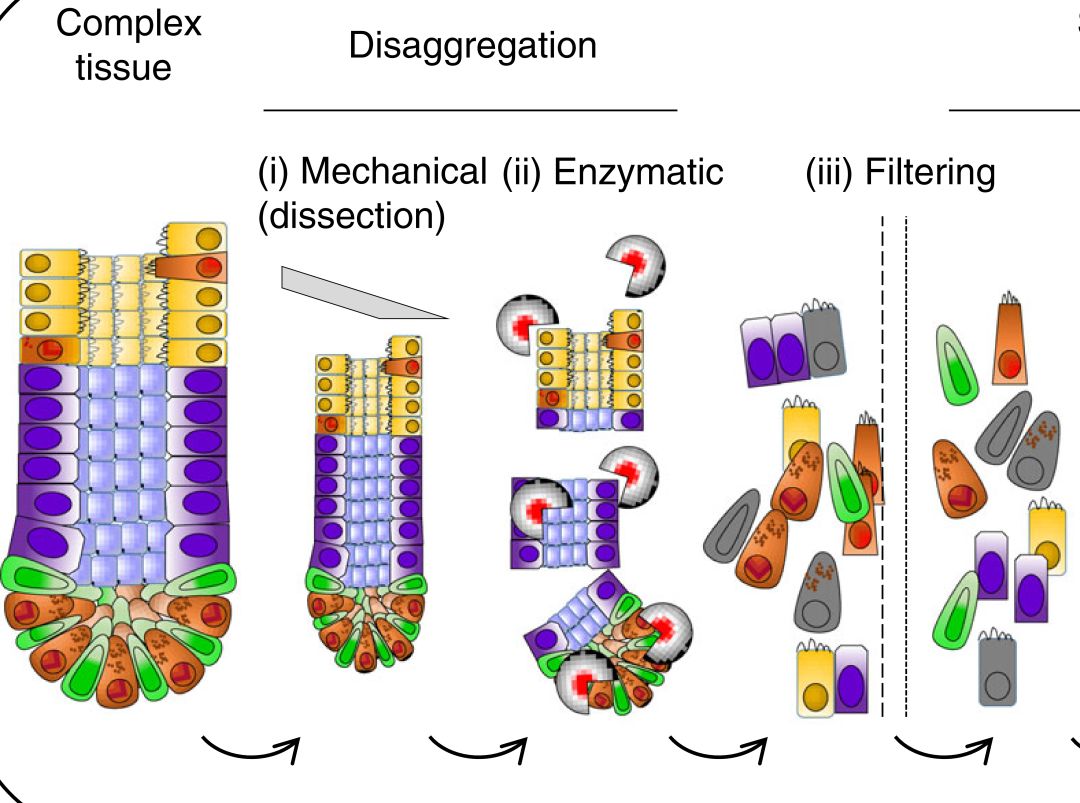
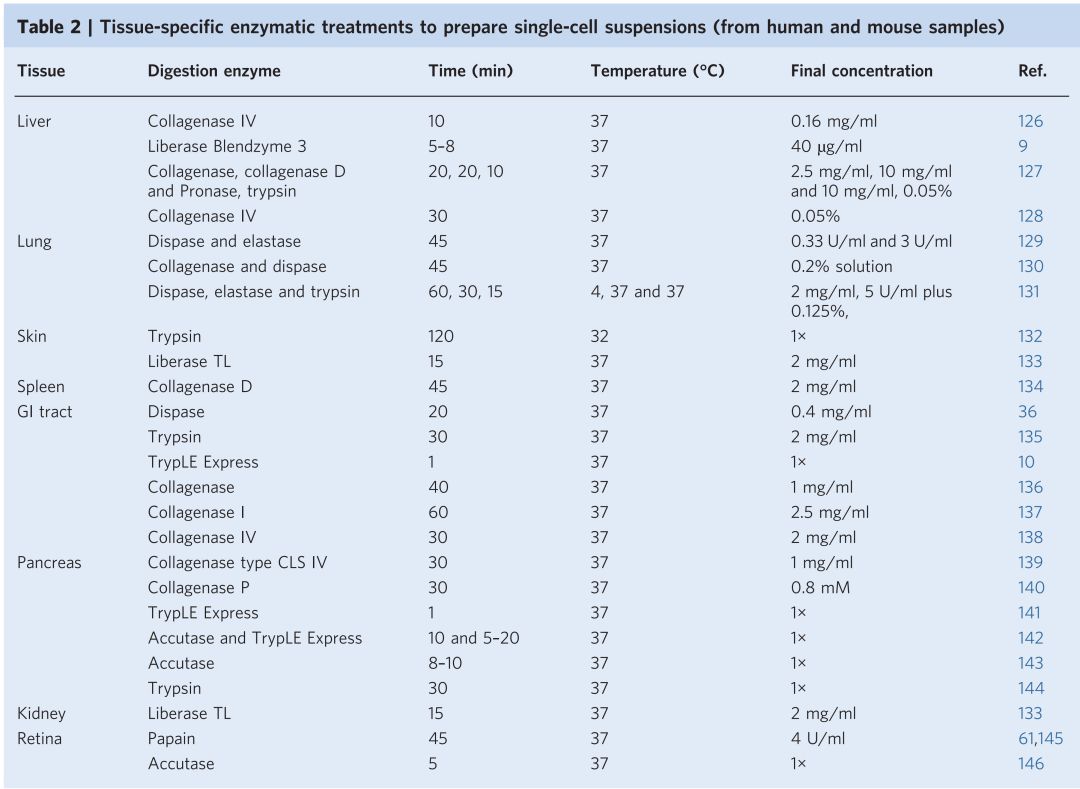
- 細胞懸浮液的製備:為了取得單細胞,組織樣品要先用物理方式和化學方式進行處理(disaggregation),物理方式是用刀片進行切割和碎裂然後再使用脢切的化學方式分離細胞(組織與酵素和作用時間的對照表如下)。脢切後通常會造成細胞的聚集,這時候見亦可以使用DNase I 來處理降低細胞聚集的現象。接著,就要進行過濾的步驟得到純化後的細胞。這邊必須要特別注意的是,樣品在經過這些步驟後可能會導致細胞活性與基因調控的改變,而較為敏感的細胞經過這些步驟甚至有可能會受損,因此操作的時間能越短越好以避免後續經過單細胞定序(scRNA-seq)所產出的數據不真實。
- 樣品的保存:大部分的用來進行單細胞定序(scRNA-seq)的樣品都是新鮮細胞,但是由於研究和臨床實驗的特殊性,這些機構幾乎都缺乏足夠的設備,導致對於這些樣品進行快速處理幾乎非常困難。再者,有些樣品必須要在多個不同時間進行採樣,為了避免誤差,這些樣品需要在同一時間進行單細胞實驗。因此,有效的樣品保存方案是非常重要的。研究指出,把樣品保存在-80度或是液態氮中一年,其基因體或是RNA的完整程度和新鮮細胞幾乎沒有差異。另外,甲醇固定已經被確定為保存樣品基因體和RNA訊息完整的一種優良的方法。所以,不論是低溫保存法或是甲醇固定都是保存樣品非常良好的方式。最後,針對快速冷凍的樣品,細胞核定序是唯一解決的單細胞定序(scRNA-seq)解決方案,這是因為在快速冷凍的過程中會形成冰晶破壞細胞膜,但並不會破壞細胞核。
更多對於單細胞定序(scRNA-seq)操作指南請閱讀 "Nature Protocols"



